반응형
주제 : 증기압(Vapor Pressure)의 정의와 이해
Vapor Pressure 는 우리말로 "증기압" 을 말합니다.
과학에서는 물질의 상태를 고체, 액체, 기체 3가지로 정의합니다.
단계별 물질의 상태를 Phase(상) 이라고 하며 각 상은 온도, 압력에 따라 물질의 변화를 수반합니다.
증기압은 이러한 상 변화와 밀접한 관련이 있는 물질의 고유 특성입니다.
플랜트 산업의 화학 공정에서는 물질의 증기압이 항상 등장합니다.
앞서 이야기 한것처럼 온도, 압력의 변화에 따라 물질의 상이 변하고 이는 공정내에서 체적 볼륨의 변화를 가져올 수도 있고, 액상으로 변하거나 혹은 기체 상태로 변한다는 사실에 주목할 필요가 있습니다.
실제로 증기압은 공정 설비를 설계하는 데 있어서주요 공정 변수 중에 하나입니다. 증기압을 어떻게
정의하고 직관적으로 이해할 수 있을까요?

증기압(Vapor Pressure)의 정의
증기압은 사전적으로 아래와 같이 정의합니다.
" 특정 물질이 온도상태에서 열역학적 평형을 이루는 증기에 의해 가해지는 압력"
蒸(찔 증)氣(기운 기)壓(누를 압)
한문으로 표기된 증기압을 풀어서 직역하면
"증기 기운의 압력" 으로 해석할 수 있습니다.
증기압의 단위
증기압은 용어에서 나타난 Pressure 에서 알 수 있듯이 압력 단위를 사용합니다.
- Pa (SI 표준단위)
- bar
- mbar
- mmHg
- inHg
- torr (주로 진공압력을 표기할 때 사용하지만 요즘에는 잘 사용하지 않습니다)
- kg/cm² (오래전에 국내에서 많이 사용한 압력 단위였지만 SI 표준단위계 적용으로 사용하지 않습니다)
증기압을 어떻게 하면 직관적으로 이해할 수 있을까요?
이를 위해서 먼저 표준물질의 대명사인 물(Water)의 온도와
증기압의 관계를 살펴 보겠습니다.
아래 테이블에서는 물의 온도에 따른 증기압(mmhg & Pa) 을 나타낸 표 입니다.
표를 보고 이해하는 방법은 예를 들어 물의 온도가 30°C 라면
이 때 물이 가지고 있는 증기압은 31.67 mmHg (4,222.33 pa) 를 뜻 합니다.
Water Vapor Pressure Table
|
T (oC)
|
Psat (mm Hg)
|
Psat (Pa)
|
|
0
|
4.4518
|
593.53
|
|
10
|
9.0477
|
1206.27
|
|
20
|
17.3623
|
2314.79
|
|
30
|
31.6701
|
4222.33
|
|
40
|
55.2254
|
7362.78
|
|
50
|
92.5113
|
12333.82
|
|
60
|
149.4990
|
19931.56
|
|
70
|
233.9089
|
31185.28
|
|
80
|
355.4605
|
47390.83
|
|
90
|
526.1027
|
70141.25
|
|
100
|
760.2143
|
101353.56
|
|
110
|
1074.7682
|
143290.64
|
|
120
|
1489.4536
|
198577.48
|
|
130
|
2026.7527
|
270211.47
|
|
140
|
2711.9709
|
361566.38
|
|
145
|
3135.2790
|
418002.82
|
|
160
|
4641.3583
|
618796.88
|
|
170
|
6004.4974
|
800533.81
|
|
180
|
7534.8083
|
1004558.49
|
|
190
|
9434.4587
|
1257824.38
|
|
200
|
11689.3016
|
1558445.37
|
|
210
|
14341.7076
|
1912070.42
|
|
220
|
17435.7135
|
2324570.62
|
|
230
|
21016.7699
|
2802005.54
|
|
240
|
25131.4808
|
3350588.55
|
|
250
|
29827.3411
|
3976651.76
|
Water Vapor Pressure VS Temperature
위의 테이블을 그래프로 만들어 보면 다음과 같습니다.
그래프를 통해서 직관적으로 확인할 수 있는 것은 바로

<Water Vapor Pressure Vs. Temperature>
- 온도가 올라가면 증기압도 올라간다는 것 입니다.

증기압의 이해 다음 단계로 넘어가기에 앞서
다른 물질을 하나 또 예로 들어 보겠습니다.
상대적으로 많이 들어본 가스의
대표주자인 프로판(Propane) 가스의 증기압은 어떨까요?
Propane(프로판) Vapor Pressure Table
|
T (oC)
|
Psat (mm Hg)
|
Psat (Pa)
|
|
0
|
3553.7479
|
473794.08
|
|
10
|
4761.9051
|
634868.47
|
|
20
|
6242.9553
|
832325.59
|
|
30
|
8026.7290
|
1070142.52
|
|
40
|
10141.6175
|
1352104.46
|
|
50
|
12614.1841
|
1681752.90
|
|
60
|
15468.8626
|
2062345.39
|
|
70
|
18727.7378
|
2496826.35
|
|
80
|
22410.4016
|
2987807.82
|
|
90
|
26533.8755
|
3537559.12
|
|
100
|
31112.5893
|
4148004.09
|
|
110
|
36158.4086
|
4820724.68
|
|
120
|
41680.7003
|
5556969.68
|
|
130
|
47686.4284
|
6357667.58
|
|
140
|
54180.2736
|
7223442.39
|
|
145
|
57745.3538
|
7698747.34
|
|
160
|
68640.4476
|
9151307.04
|
|
170
|
76916.4490
|
10254683.15
|
|
180
|
85058.4085
|
11340188.47
|
|
190
|
93993.1484
|
12531389.16
|
|
200
|
103404.2958
|
13786105.62
|
|
210
|
113284.6989
|
15103384.37
|
|
220
|
123626.1157
|
16482126.55
|
|
230
|
134419.3494
|
17921106.02
|
|
240
|
145654.3755
|
19418986.32
|
|
250
|
157320.4616
|
20974336.54
|
Propane Vapor Pressure VS Temperature

- 물은 30°C 에서 31.67 mmHg 의 증기압을 가지고 있습니다.
- 프로판은 30°C 에서 8026.729 mmHg 의 증기압을 가지고 있습니다.
같은 온도 조건에서 산수로 계산해보면
프로판의 증기압이 무려 ≒253 배(8026.729/31.67=253.45)
높다는 것을 알 수 있습니다.
이것이 의미하는 것은 무엇일까요?
이는 중요한 내용이므로 아래에서 설명하겠습니다.
앞선 그래프를 통해서 확인 하였듯이 증기압은 온도와 밀접한 관련이 있습니다.
물질의 온도가 상승하면서 증기압이 올라간다는 결국 분자의 움직임이
활발해진다는 것을 의미합니다.
이는 다시 말해 상의 변화를 말하는 것이지요.
자세히 들여다보지 않으면 눈치 챌 수 없지만 대기 상태에
놓여져 있는 액체는 끊임없이 증발하고 있습니다.
아래 사진과 같이 말이죠.

반대로 몹시 추운 한 겨울에 마당에 뿌려놓은 물은 얼거나 잘 마르지 않는다는 사실을 상식적으로 알 수 있습니다.
증기압을 자연현상과 대조하여 이해해 보겠습니다.
온도가 30° 화창한 어느 날 야외에 나가 그릇에 물을 부어 보겠습니다.
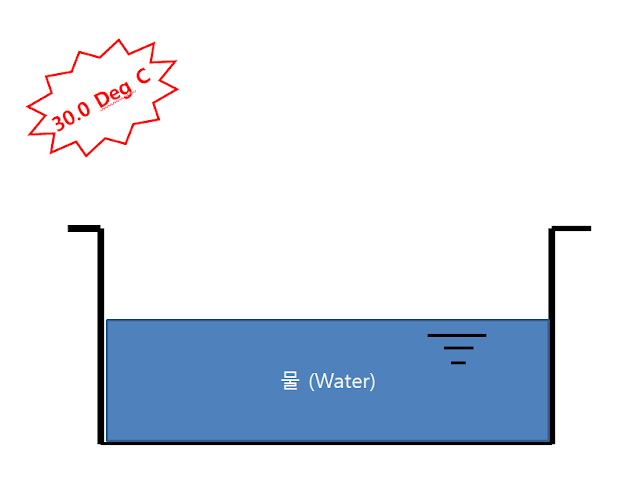
- 물의 증기압은 30 °C 에서 31.67 mmHg 입니다.
- 그리고 표준 대기압은 760 mmHg 입니다. 이 내용을 그림에 표기해 보겠습니다.
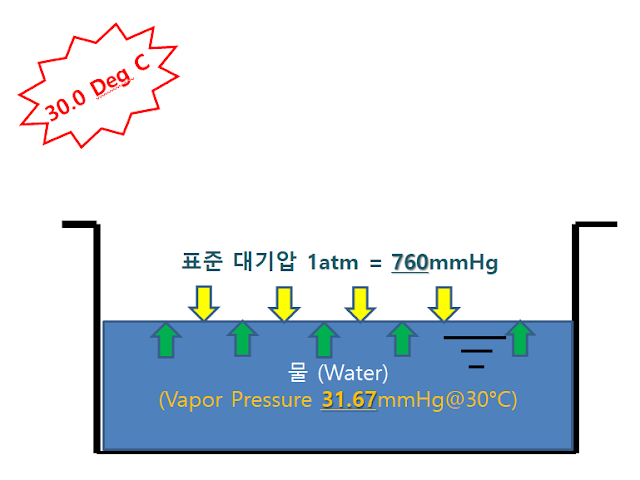
- 야외에 나가서 그릇에 물을 채워 넣고 상태를 지켜봤는데 단시간 내에 기체로 변하는 상 변화를 일으키지 않습니다.
- 다음으로 물을 끓여서 온도를 100 °C 로 높여 보겠습니다.
- 물은 이 때 증기압이 상승합니다. 라면을 끓여 봐서 알 수 있듯이 물은 보글 보글 끓기 시작합니다.
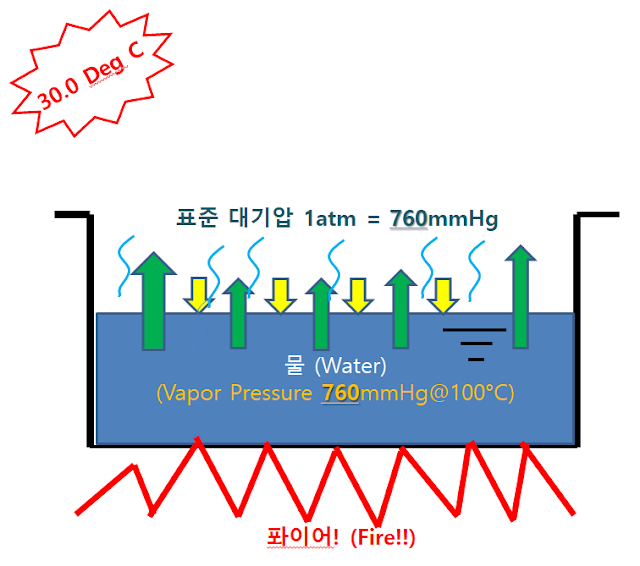
- 물이 끓는 이유는 간단합니다. 증기압이 상승하고 비점에 도달했기 때문이죠.
- 그림에서 글쓴이가 의도한 것은 녹색의 증기압이 대기압보다 점점 커지고 있다는 것을 의미합니다. 위의 내용을 다음과 같이 정리할 수 있습니다.
- 물은 30도에서 31.67 mmHg 의 증기압을 가지고 있으며 대기압보다(760 mmHg) 작으므로 열적 평형상태 이하로 내려가 상변화를 일으키지 않습니다.
- 물의 온도를 100도 이상으로 가열하자 증기압이 대기압인 760 mmHg 보다 상승하여 열적평형상태가 깨어지고 비점에 도달하여 상변화를 일으키게 됩니다.
프로판은 앞서 기술한 것처럼 물보다 증기압이 높습니다.
따라서 대기 상태에 노출될 경우 바로 기체가 된다는 것을 알 수 있습니다.
이처럼 증기압이란 각 물질이 가지고 있는 표면에 작용하는 힘으로 정의할 수 있습니다.
힘이 세면 그 만큼 분자의 움직임이 활발하다는 것이고 그만큼 쉽게 기화되고 기체화 된다는 것을 의미합니다.
증발과 응축작용은 계속적으로 반복되는 현상입니다.
모든 물질은 해당 물질이 가지고 있는 증기압내에서 평형을 유지하게 됩니다.
밀폐된 공간 내에서 물질에 열을 가할 면 내부의 증기압력이 증가하게 되고 용기가 폭발하거나 물질이 더는 증기압이
올라가지 못하거나 둘중에 하나의 현상이 발생합니다.
표준물질인 물이 대기압 상태에서 액체 상태를 유지하는 것은 (물론 증발현상을 수반합니다) 대기압 보다
낮은 증기압을 가지고 있기 때문이죠.
이렇게 상이 액체 상태를 유지하는 것을 응축이라고 합니다.
다시 말해 증기압이 낮기 때문에 얌전히 오밀조밀 모여있는 상태의 열적 평형상태가 된 것이고 온도가 상승하면
증기압이 세져서 얌전했던 분자들이 활발해지면서 상변화가 되는 것입니다.
내용정리
증기압이란 열적 평형상태의 액체 표면에 작용하는 압력을 말하며
물질의 주요 특성 중에 하나입니다.
본문에서는 물과 프로판 두가지만 예로 들었지만 현업에서는 굉장히 많은 화학 물질을 다루게 됩니다.
서론에서 이야기 한 것처럼 화학 공정내에서 유체의 흐름을 제어할 때 증기압은 주요 공정 변수중에 하나 입니다.
물질을 액체 상태로 이송할 것인지, 기체 상태로 이송할 것인지에 따라서 온도와 압력을 조절하게 되는 것이지요.
본문에서는 물과 프로판 두가지만 예로 들었지만 현업에서는 굉장히 많은 화학 물질을 다루고 계산서를 작성할 때
빠지지 않는 공정변수라는 점을 기억해야 겠습니다.
Inside Insight 였습니다.
INSIDE INSIGHTS ENCYCLOPEDIA
반응형
'엔지니어링 기술자료' 카테고리의 다른 글
| 밀도(Density)의 정의와 이해 (0) | 2023.11.13 |
|---|---|
| 비중(Specific Gravity)의 정의와 이해 (0) | 2023.11.13 |
| 탈염공정 (Desalting Process) (0) | 2023.11.13 |
| 전기의 유형 3가지 (직류,교류) (0) | 2023.11.13 |
| Gas Absorber(Stripper) 공정 (0) | 2023.11.13 |


댓글